Méthode de production de Liposomes
S’il existe de nombreuses méthodes pour produire des liposomes en faible quantité, seules quelques-unes sont adaptées à la production à l’échelle industrielle. Les critères d’évaluation de ces méthodes dépendent de différents facteurs comme la teneur en lipides, le temps de production, le budget, le niveau de qualité des lipides exigé mais également de la teneur des ingrédients actifs encapsulés.
Différentes méthodes valables, qu’elles soient ascendantes ou descendantes, permettent de créer des liposomes. Considérant que les phospholipides se créent en général spontanément sous forme de structures en double couches en état d’hydratation, toutes les méthodes descendantes, y compris celle utilisant l’appareil Microfluidizer, ne produisent pas de liposomes à proprement parlé, mais opèrent plutôt une réduction de la taille initiale des lipides. Cela permet aux liposomes de s’agréger par eux-même en vésicules de la taille et à l’indice de lamellarité souhaités. Les méthodes ascendantes, quant à elles, permettent la création de liposomes par précipitation selon la taille et la lamellarité exigées.
Pourquoi utiliser la technologie Microfluidics ?
Des liposomes de grande qualité
Un cisaillement stable et uniforme est obtenu grâce à la chambre d’interaction à géométrie fixe et la pression constante du système de pompage de l’appareil Microfluidizer. Cette technologie permet de produire des vésicules uni-lamellaires uniformes et de taille réduite (PVU). Dans la majorité des cas, la technologie Microfluidizer est capable de réduire la taille des liposomes jusqu’à environ 40 – 50 nm.
Une haute concentration
Le Microfluidizer produit immédiatement des solutions de liposomes à haute concentration d’agents thérapeutiques et ce, sans nécessiter de traitement en aval pour concentrer le produit. La concentration de lipides dans les médicaments liposomaux prêts à l’emploi varie entre 5mM et 25mM. La technologie Microfluidizer est capable de produire des liposomes compris dans cette fourchette et même au–delà, jusqu’à 100mM. Selon différentes données publiées, cela représente un ou deux ordres de grandeur supérieurs aux concentrations de lipides contenues dans une solution de liposomes finale obtenue par la méthode d’injection de solvants qui présente généralement une échelle comprise entre 0,1mM et 2,0 mM (millimolaire ⎼ 10-3 mol/L).
Une réduction de taille très rapide
La réduction de taille des vésicules de liposomes est effectuée via un processus très rapide, en comparaison avec des processus lents comme les techniques par extrusion ou l’utilisation de puces microfluidiques. Le Microfluidizer de laboratoire présente une capacité de production de 1 à 3 litres toutes les 10 minutes. Dans une unité de production, il peut fabriquer des centaines de litres par heure.
La scalabilité
Il est important de prendre en compte la scalabilité du processus lors du passage des essais précliniques à l’usage clinique, voire à l’échelle de production industrielle. La plupart des méthodes alternatives présentent une faible scalabilité. Depuis plusieurs dizaines d’années, la technologie Microfluidizer a prouvé sa capacité de scalabilité permettant de fabriquer une large gamme de produits pharmaceutiques ou non-pharmaceutiques en des quantités atteignant les milliers de litres. L’appareil Microfluidizer permet d’obtenir des concentrations thérapeutiques quelle que soit la quantité de produit souhaitée. Les technologies alternatives comme la méthode de puce microfluidique ne permettent que la dilution de produits concentrés. Cela signifie que la production de grands volumes de produits nécessite une haute concentration obtenue en aval afin d’aboutir à l’obtention de doses thérapeutiques.
Pas besoin de solvant
Dans la plupart des cas, l’usage de solvant n’est pas indispensable dans le processus de réduction de taille effectué par le Microfluidizer. Cela évite de passer par une étape supplémentaire d’élimination du solvant au cours de la production. Néanmoins, si votre formule nécessite l’usage d’un solvant, vous pouvez tout à fait utiliser l’appareil Microfluidizer qui est, bien entendu, compatible avec la plupart des solvants.
Un système respectant les bonnes pratiques de fabrication et compatible CIP/SIP
Les appareils Microfluidizer sont conçus en conformité avec les règles de Bonnes Pratiques de Fabrication et les modes de nettoyage CIP/SIP. La simplicité volontaire du design du Microfluidizer le rend très facile à utiliser et à nettoyer entre chaque lot de produit sans qu’il soit nécessaire de le démonter.
La qualité thérapeutique des éléments actifs
La température du produit peut être contrôlée aisément grâce à un système de refroidissement hautement efficace. Toutefois, concernant l’industrie biopharmaceutique, le haut taux de cisaillement obtenu grâce à notre technologie peut causer quelques désagréments lors de l’encapsulation de certains produits biologiques. En effet, la force de cisaillement peut entraîner une fragmentation de l’ADN et une agrégation de protéines ainsi qu’un changement de conformation pouvant affecter l’activité et la solubilité des produits. Certaines protéines de grande taille telles que l’ovalbumine deviennent alors plus stables et peuvent résister à un plus grand degré de stress et à un plus haut taux de cisaillement. Cependant, nos exemples concluants en matière de rupture démontrent que nos technologies sont peu susceptibles de causer des dommages aux produits biologiques. Enfin, peu de formules de liposomes impliquent des molécules de grande taille. Tous les produits commercialisés contenant des liposomes sont constitués de petites molécules. De manière générale, les phospholipides ne sont pas dénaturés par les températures relevées lors du fonctionnement du Microfluidizer, en particulier celles qui, comme le DSPC présentent une température de transition élevée.
La flexibilité
Des liposomes de différentes tailles ainsi que différentes formules peuvent être fabriquées avec le même appareil Microfluidizer en modifiant les paramètres de l’opération. La taille des liposomes obtenus peut être estimée avec une grande précision.
La filtration stérile
Des études menées par Pall Life Sciences confirment que les liposomes obtenus grâce au Microfluidizer peuvent tout à fait être filtrés via un filtre à 200nm.
Choisir entre les différentes technologies préparatives
Plusieurs technologies ont été développées pour la préparation des liposomes. Ces méthodes sont généralement divisées en trois catégories.
1 La méthode par hydratation des lipides
Cette méthode descendante classique est utilisée en général pour produire de grandes vésicules unilamellaires (GVU) et des vésicules multicouches (VMC). Il s’agit ensuite d’opérer une réduction de taille des vésicules en utilisant différentes techniques mécaniques.
2 La méthode par injection de solvants
Cette méthode ascendante repose sur la génération immédiate de PVU et GVU en modifiant les conditions de solubilité de solutions de phospholipides via le remplacement de solvants lipo-solubilisants par un média non-solvant à base d’eau.
3 La méthode par élimination de détergent (tensio-actif)
Cette méthode est assez peu utilisée. De ce fait, nous ne l’aborderons pas ici.
Les phospholipides de haute qualité peuvent s’avérer très coûteux, ce qui constitue un facteur déterminant dans le choix de la méthode préparative.
Créer des liposomes à partir de solutions lipidiques comparés au procédé à film mince
La méthode utilisant des puces à basse pression évite le passage par l’étape du film mince, mais nécessite une étape supplémentaire pour éliminer le solvant afin de concentrer la solution par la suite. Si le traitement en aval constitue une préoccupation majeure, l’appareil Microfluidizer peut vous permettre de produire des liposomes en évitant l’utilisation préalable de film mince.
Il existe un certain nombre de procédés pour obtenir des liposomes à partir de solutions lipidiques en utilisant le Microfluidizer.
- Dans la première méthode, tous les ingrédients lipidiques et les médicaments lipophiles sont dissouts dans un solvant comme l’éthanol. La solution est ensuite mélangée à une phase aqueuse, pré-traitée avec un mixeur à bas cisaillement avant d’être passée au Microfluidizer à la manière d’une émulsion. Ce procédé est assez similaire à la méthode par injection de solvant mais présente des mécanismes de formation des vésicules différents. La méthode par injection est une méthode ascendante qui crée des vésicules de liposomes autonomes. En revanche, la méthode présentée ici crée des MCV pendant la phase de pré-mélange puis des PVU lors de l’utilisation du Microfluidizer. Attention, notez que le solvant doit être éliminé à la fin du processus.
- La méthode de double émulsion pour la préparation de liposomes est généralement utilisée pour les encapsulations d’actifs hydrophiles. Pour cette méthode, une phase aqueuse contenant des médicaments hydrophiles et une solution lipidique, obtenue par la dissolution de tous les lipides dans un solvant non-miscible à base d’eau, comme le chloroforme, sont préparées séparément. La première phase aqueuse est ensuite ajoutée à la solution pour obtenir un mélange du type eau-dans-l’huile (E/H). La solution E/H est ensuite mélangée à la seconde solution aqueuse pour obtenir une émulsion E/H/E. Les deux émulsions sont préparées avec le Microfluidizer. Après évaporation du solvant par brassage, des vésicules de liposomes se forment dans la dernière solution. Cette méthode présente un taux d’encapsulation très élevé. De récentes publications indiquaient un taux de 80% d’encapsulation d’ADN plasmique dans deux formules de liposomes cationiques différentes.
| Méthodes | Avantages | Inconvénients | |
| Hydratation des lipides suivie d’une réduction mécanique de la taille des particules | Microfluidizer | – Facile à utiliser
– Réduction de la taille des éléments rapide et efficace – Particules plus petites et uniformes (comparées à l’HVPH et aux ultrasons) – Pas besoin de solvants – Contrôle de la température – Scalabilité garantie |
|
| Extrusion | – Vésicules de petite taille et relativement égales
– Pression légère et cisaillement limité – Pas de variation de température |
– Fastidieux et peu fiable
– Scalabilité limitée – Pertes de produits dues aux fuites et aux obstructions – N’élimine pas totalement les MCV – Les médicaments contenus dans la membrane peuvent en diminuer la flexibilité et limiter la délivrabilité des actifs |
|
| Homogénéisation par valve à haute pression (HPVP) | – Seule alternative valable pour les gros volumes | – La faible force de cisaillement et les variations de pression entraînent un manque d’homogénéité du produit et l’obtention de particules de grande taille, ce qui oblige à procéder à plusieurs passages
– Scalabilité indirecte – Problèmes de refroidissement et de nettoyage |
|
| Ultrasons | – Forces de cavitation très élevées à la pointe de la sonde | – Surchauffe localisée et manque de contrôle de la température
– Force de cisaillement non-uniforme – Destruction des bicouches du fait de la force de cisaillement localisée – Peu d’efficacité d’encapsulation – Manque de scalabilité – Contamination par la pointe de la sonde métallique |
|
| Injection de solvants | Puce micro fluidique | – Faible cisaillement
– Pas de variation de température – Distribution homogène des tailles de particules – Contrôle des tailles de particules – Scale-up possible par l’utilisation de plusieurs puces en parallèle pour de faibles volumes |
– Utilisation de solvant organique
– Production d’une solution de liposomes très diluée – Processus de diffusion naturellement lent (besoin de maintenir l’écoulement laminaire) – Une dilution supplémentaire est nécessaire pour stabiliser les particules – Étapes supplémentaires pour éliminer les solvants / concentrer le produit (il est très difficile d’éliminer l’éthanol) – Problèmes de compatibilité solvant/puce – Difficultés à contrôler la température – Scalabilité à l’échelle industrielle difficile (nécessité de contrôler très précisément les débits et les proportions) – Coût élevé (puces à usage unique) |
| Injection par buse tangentielle | |||
Les avantages d’une chambre d’interaction à géométrie fixe et d’une pression constante
La technologie Microfluidizer utilise une zone de cisaillement élevée à géométrie fixe et des pompes à pression constante. Cette combinaison unique garantit que chaque microlitre de produit reçoit le même traitement, et ce pour une production de 1mL comme de centaines de litres.
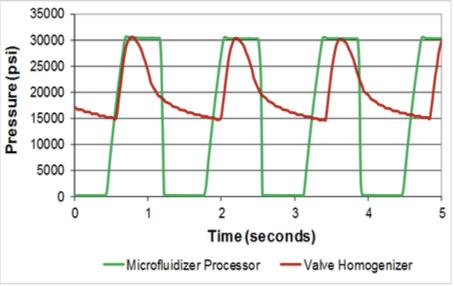
La courbe de pression de l’appareil Microfluidizer comparée à celle d’un homogénéisateur classique. Nous pouvons noter que la pression de l’homogénéisateur ne fait que culminer brièvement à la pression souhaitée alors que le Microfluidizer soumet la totalité de l’échantillon à la même pression.
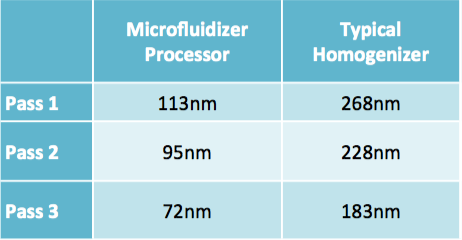
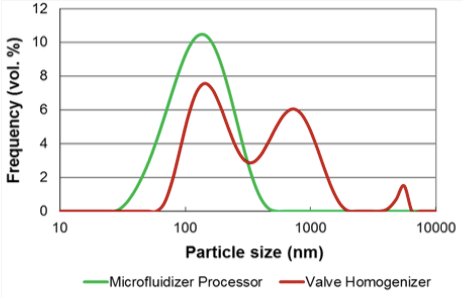
L’appareil Microfluidizer présente une dispersion limitée des liposomes unimodaux comparé à la méthode par homogénéisateur.
Les facteurs essentiels pour le développement de nanoparticules polymères liposomales
Formule
- Type, température de transition et quantité de phospholipides
- Source des phospholipides
- Ingrédients Pharmaceutiques Actifs (IPA)
- Le ratio lipides/solvant et/ou lipides/IPA
Conditions de fabrication
- Pré-mélange ( température, temps, co-solvants)
- Pression
- Type de chambre d’interaction
- Nombre de passages
- Profil de température durant la fabrication
Autres facteurs
- pH
- Ajout de tensioactifs supplémentaires comme le polysorbate
- Exhausteurs de viscosité comme le glycérol
- Exhausteurs d’agglomération pour la lyophilisation
Comment faire un bon pré-mélange ?
- Les API sont-ils hydrophobes ou hydrophiles ?
- Les actifs sont-ils sous forme liquide ?
- Si ce n’est pas le cas, ils doivent être fondus, dissous dans une phase huileuse ou mélangés aux phospholipides.
L’hydratation des phospholipides : un élément essentiel
- Température au dessus de Tm (température de phase de transition)
- Un mélange à haut cisaillement est préférable (mais on prendra garde à ne pas introduire d’air)
- L’hydratation peut prendre plusieurs heures, en utilisant par exemple un mélangeur rotor-stator pendant deux heures à une température de 5-10ºC au-dessus de T
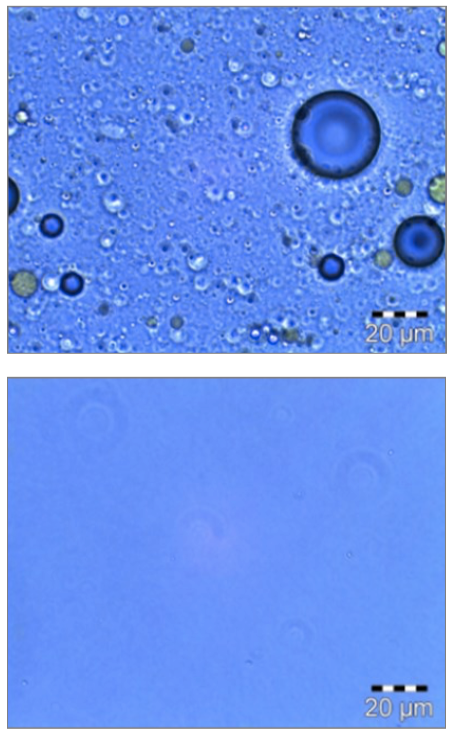
Photomicrographies avant/après de la préparation de liposomes.
Etude de cas numéro 1
Entreprise : Une grande entreprise pharmaceutique basée aux Etats-Unis
Emploi : Traitement de carcinomes
Matériaux : Actif pharmaceutique peu soluble dans l’eau avec une température de fusion inférieure à 60ºC
Objectif : Analyser diverses conditions de traitement et de fabrication afin de produire une préparation de liposomes et des actifs à une échelle comprise entre 50nm et 150nm
Protocole
Etape 1
Phase aqueuse : Liposomes hydratés dans l’eau par brassage pendant deux heures à 60ºC pour assurer une hydratation complète.
Phase huileuse : Ingrédients actifs fondus à 60ºC et ajoutés à la phase aqueuse.
Etape 2
Création du pré-mélange en utilisant un mélangeur rotor-stator afin d’obtenir une pré-émulsion stable.
Etape 3
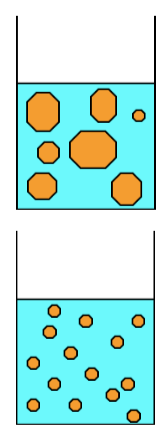
Liposomes multilamellaires + actifs

Traitement par Microfluidizer
Vésicules unilamellaires contenant les actifs encapsulés
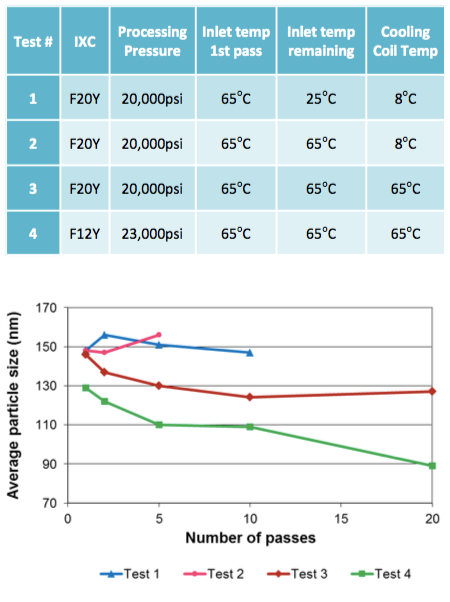
Développement des processus préliminaires

Développement de la formule préliminaire
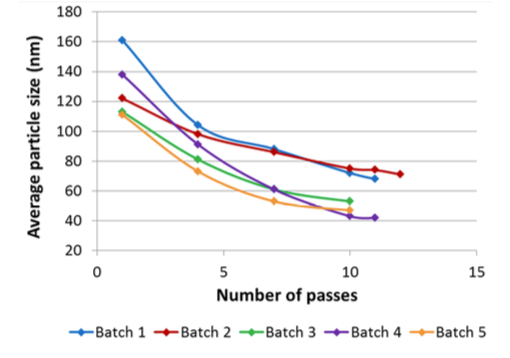
Processus additionnels et développement de la formule
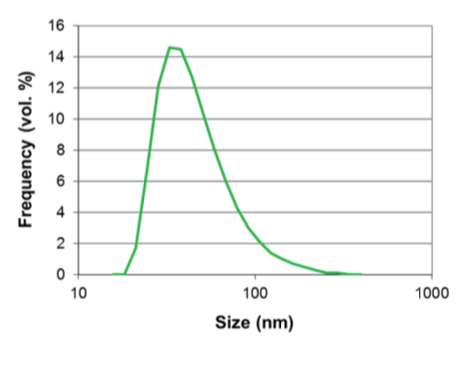
Distribution granulométrie pour la formule finale retenue et modalités de processus
Conclusion
Le Microfluidizer a été capable de produire la taille de particules désirée ainsi qu’une dispersion uni-modale avec toutes les formules testées, et dans certains cas, après un seul passage. En outre, différentes distributions prévisibles de tailles de liposomes ont été obtenues, permettant une optimisation des futurs protocoles thérapeutiques.
Etude de cas numéro 2
Entreprise : Une grande entreprise pharmaceutique basée en Inde
Emploi : Traitement des infections bactériologiques résistantes à la pénicilline
Matériaux : Actif pharmaceutique peu soluble dans l’eau dissout dans l’huile de sésame
Objectif : Produire la formule du client grâce à un Microfluidizer de laboratoire (M110EH) pour démontrer que le procédé est reproductible, puis passer à l’échelle industrielle en conservant les mêmes résultats. Le processus sera comparé avec les résultats obtenus par une transformation via la méthode de traitement par pression constante.
Méthode pour obtenir un pré-mélange de liposomes
Etape 1
Phase aqueuse : Liposomes hydratés dans l’eau par brassage pendant deux heures à 60ºC pour assurer une hydratation complète.
Phase huileuse : Ingrédients actifs dissouts dans une huile végétale à 40ºC pendant 10 minutes jusqu’à dissolution complète.
Etape 2
Création du pré-mélange en utilisant un mélangeur rotor-stator afin d’obtenir une pré-émulsion stable.
Etape 3

Liposomes multilamellaires + actifs

Traitement par Microfluidizer
Vésicules unilamellaires contenant les actifs encapsulés
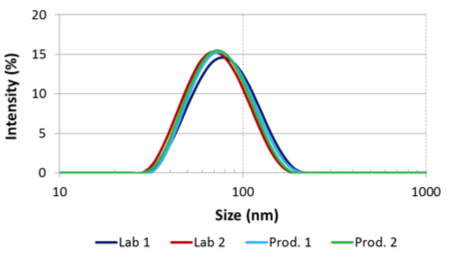
Résultats
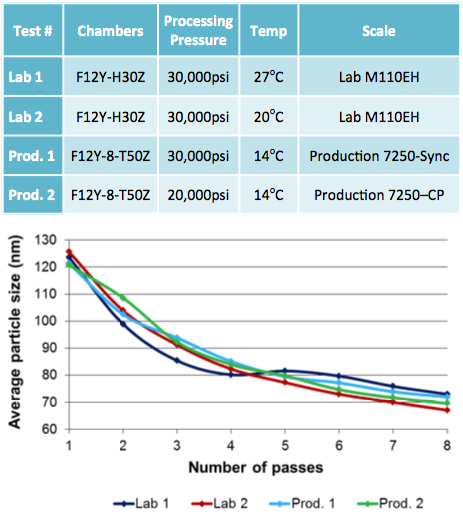
Distribution granulométrique pour la formule finale retenue et modalités de processus
Conclusion
Le Microfluidizer a été capable de produire la taille de particules désirée, qui est inférieure à 220nm avant la filtration stérile ainsi qu’une dispersion uni-modale avec toutes les formules testées, et dans certains cas, après un seul passage. Les tests de scale-up ont montré que les mêmes résultats pouvaient être obtenus en laboratoire et à échelle de production en utilisant un modèle de Microfluidizer conçu à la fois pour de faibles (M110EH) et de larges volumes (M7250). Pour cette étude, nous avons testé un plusieurs quantités allant de quelques centaines de millilitres à plusieurs dizaines de litres. Des résultats complémentaires illustrent la faible réduction de taille de particules obtenue par le système de pression constante en unité de production.
Etude de cas numéro 3 : Encapsulation – liposome
5 passes à 1300 bar avec la chambre F20Y (75µm)
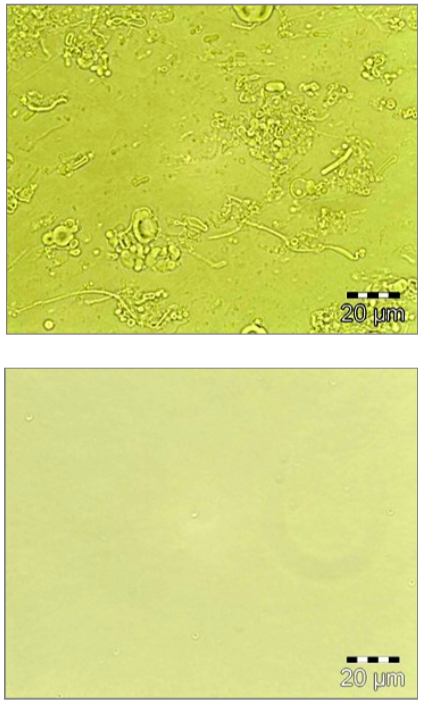
Photomicrographies avant/après de la préparation de liposomes.
Distribution granulométrique pour la formule finale retenue et modalités de processus
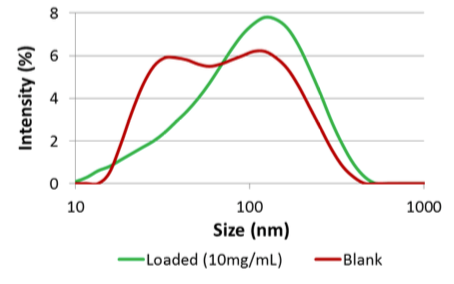
Etude de cas numéro 4 : Encapsulation -liposome
0,1% d’ADN plasmide est encapsulé dans un liposome de Palmitoyl oleoyl phosphadityl choline. L’ADN est intact après la transformation.
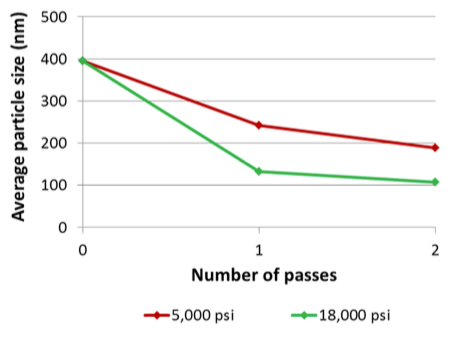
Conclusion
Le Microfluidizer a permis d’encapsuler l’ADN dans les liposomes. La pression plus importante crée des liposomes significativement plus petits. Il a été constaté que l’ADN était bien intact après les passages à 5000psi et 18000psi.


